24-03-2024 - Physics - Fundamentals of thermodynamics (2/13) [EN]-[IT]

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
24-03-2024 - Physics - Fundamentals of thermodynamics (2/13) [EN]-[IT]
Fundamentals of Thermodynamics (2/13)
Here we are at the second appointment with a general review regarding thermodynamics and the physics aspects connected to thermodynamics.
Second law of thermodynamics for an isolated system
First of all, from the following formula we can understand that entropy S is an extensive quantity.
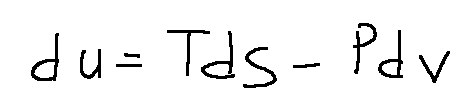
In an isolated system we remember the following:
-internal energy is constant
-quantities of heat pass from bodies at a higher thermodynamic temperature to bodies at a lower thermodynamic temperature.
-absolute temperature is measured in degrees Kelvin (°K)
The second law of thermodynamics is represented by the following formula:

Let us also remember that the evolution of a system ends when its entropy has reached its maximum.
Reversible transformations
Let us assume as a postulate that, in a system a
constant mass, the entropy flow is related only to the heat flow.
The entropy balance S is the following:
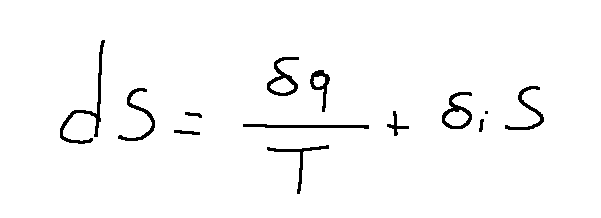
We can analyze the formula written above and deduce the following things:
-A transformation is reversible if δiS = 0
-A transformation is adiabatic if δq = 0 (there is no heat change)
-A transformation is isentropic if dS = 0 (there is no difference in entropy between the initial and final states)
-A transformation is irreversible if δiS > 0
Ideal gases
For the ideal gas model the Clapeyron relation is valid which is the following:
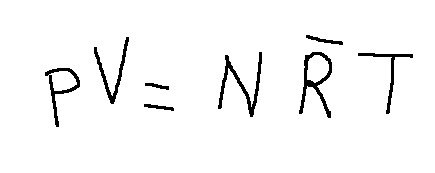
In the equation of state of ideal gases R represents the universal constant and is equal to 8314 [Pa·m3/kmol·°K]
The specific heat at constant volume depends on the gas.
To fully describe the behavior of the system it is necessary to have two equations
The fundamental relation for ideal gases is:
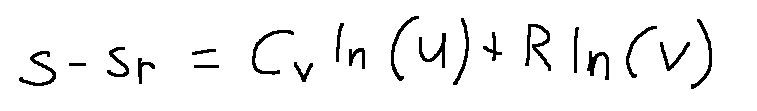
The equation of state for ideal gases is:
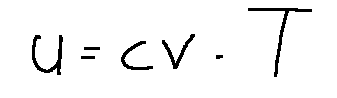
where cv is a constant that depends on the gas and is called the specific heat of the gas at constant volume.
Enthalpy
Enthalpy in physics is identified with the letter H and is defined in the following way:
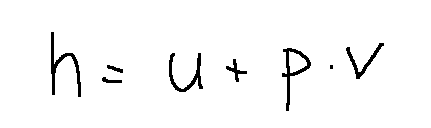
When we talk about enthalpy, the Gibbs equations can be useful. These allow the enthalpy variation to be calculated through integration, provided that the functional relationships between the quantities appearing in the second members are known.
Specific heats
cv = heat capacity at constant volume
cp = heat capacity at constant pressure
The specific heat at constant volume is greater than or equal to zero for any system.
Specific heat allows you to write a formula for calculating the heat absorbed or released starting from the mass and the temperature variation.
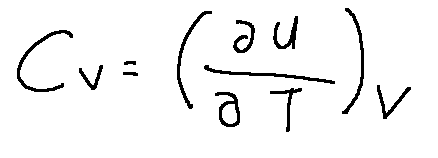
The specific heat at constant pressure depends on the enthalpy variation as a function of the temperature variation while maintaining the pressure constant.
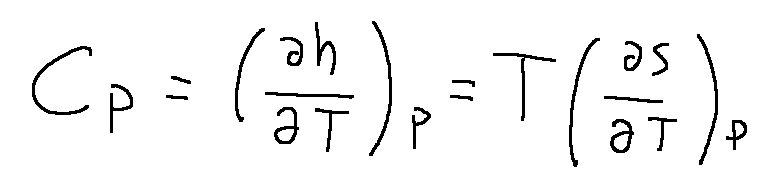
Conclusions
Second law of thermodynamics linked to the concept of entropy says that the entropy of an isolated system always increases or, at most, remains constant.
Request
Have you studied the concept of entropy or enthalpy in the past?

24-03-2024 - Fisica - Fondamenti di termodinamica (2/13) [EN]-[IT]
Fondamenti di termodinamica (2/13)
Eccoci qua al secondo appuntamento con un ripasso generale a riguardo della termodinamica e degli aspetti di fisica connessi alla termodinamica.
Seconda legge della termodinamica per un Sistema isolato
Innanzitutto dalla seguente formula possiamo capire che l'entropia S è una grandezza estensiva.
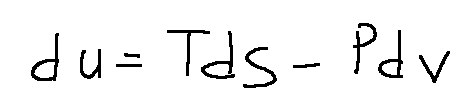
In un sistema isolato ricordiamo quanto segue:
-l'energia interna è costante
-le quantità di calore passano da corpi a temperatura termodinamica superiore a corpi a temperatura termodinamica inferiore.
-la temperatura assoluta si misura in gradi Kelvin (°K)
La seconda legge della termodinamica è rappresentata dalla seguente formula:

Ricordiamo inoltre che l’evoluzione di un sistema termina quando la sua entropia ha raggiunto il massimo.
Trasformazioni reversibili
Si assuma come postulato che, in un sistema a
massa costante, il flusso di entropia è legato solo al flusso di calore.
l bilancio dell'entropia S è il seguente:
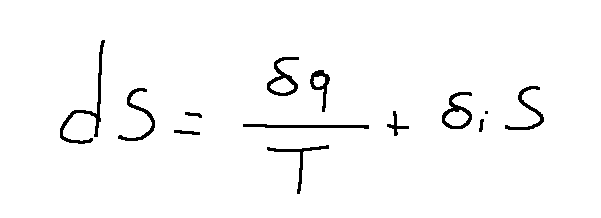
Possiamo analizzare la formula scritta sopra e dedurre le seguenti cose:
-Una trasformazione è reversibile se δiS = 0
-Una trasformazione è adiabatica se δq = 0 (non c'è variazione di calore)
-Una trasformazione è isoentropica se dS = 0 (non c'è differenza di entropia tra lo stato iniziale e quello finale)
-Una trasformazione è irreversibile se δiS > 0
I gas perfetti
Per il modello dei gas perfetti vale la relazione di Clapeyron che è la seguente:
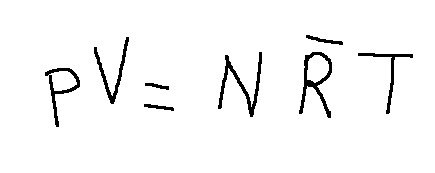
Nell'equazione di stato dei gas perfetti R rappresenta la costante universale e vale 8314 [Pa·m3/kmol·°K]
Il calore specifico a volume costante dipende dal gas.
Per descrivere compiutamente il comportamento del sistema è necessario avere due equazioni
La relazione fondamentale per i gas perfetti è:
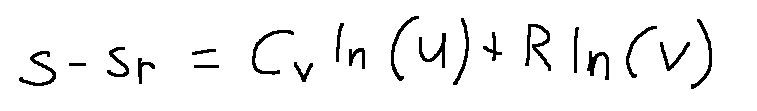
L'equazione di stato per i gas perfetti è:
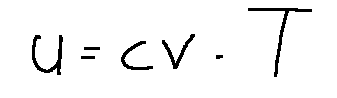
dove cv è una costante che dipende dal gas ed è detta calore specifico del gas a volume costante.
Entalpia
L'entalpia in fisica viene identificata con la lettere H ed è definita nella seguente maniera:
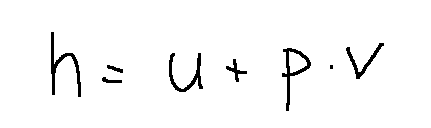
Quando parliamo di entalpia potranno tornare utili le equazioni di Gibbs. Queste permettono di calcolare la variazione di entalpia tramite integrazione, a patto di conoscere le relazioni funzionali tra le grandezze che compaiono nei secondi membri.
Calori specifici
cv = capacità termica a volume costante
cp = capacità termica a pressione costante
Il calore specifico a volume costante è maggiore o uguale a zero per qualsiasi sistema.
Il calore specifico permette di scrivere una formula per il calcolo del calore assorbito o ceduto a partire dalla massa e dalla variazione di temperatura.
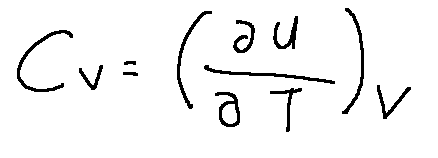
Il calore specifico a pressione costante dipende dalla variazione di entalpia in funzione della variazione di temperatura mantenendo costante la pressione.
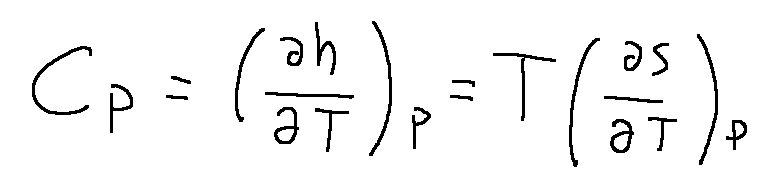
Conclusioni
Secondo principio della termodinamica legato al concetto di entropia dice che l'entropia di un sistema isolato aumenta sempre o, al più, rimane costante.
Domanda
Avete studiato in passato il concetto di entropia o di entalpia?
THE END
Congratulations @stefano.massari! You have completed the following achievement on the Hive blockchain And have been rewarded with New badge(s)
Your next target is to reach 100000 upvotes.
You can view your badges on your board and compare yourself to others in the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPReally after a long time, someone is teaching or posted on thermodyanmics. A much-appreciated post
HI @sanjeev021 Thanks for your kind words. In this article I talks about thermodynamics in general. Perhaps the most interesting thing is the part dedicated to reversible transformations.
I summarize the energy balance of entropy which is as follows
and the four most important things about it are that:
if δq = 0 the process is said to be adiabatic
if ds = 0 the process is isentropic
if δis = the process is said to be reversible
if δis > the process is irreversible
It reminds me of my classroom notes when I was preparing for examinations.
People have to increase the amount of educational content here, but not many people are aware of and interested in science.
Are you taking lectures?
I will try to create content similar to this to try to create school education here in HIVE
I also worked as a faculty I can give educational content on Chemistry.
Fantastic! then I invite you and encourage you to make chemistry posts
Can you explain further about the fact that internal energy is constant?
Hi @rafzat We can say the following. By the first law of thermodynamics, the internal energy of an isolated system remains constant. By the second law of thermodynamics, the entropy of an isolated system cannot decrease.
I try to reply at your question.
The internal energy of an isolated system remains constant due to the fact that it cannot exchange matter or energy with the outside, therefore everything remains constant. However, I would say that this is an ideal case, I don't know if there is a real case of an isolated system.
Regards
Evolution of a system ends when it entropy reaches a maximum. That means there won't be any changes at maximum entropy
I would say that you have understood the main concept, when there is a change in entropy within the system the thermodynamic transformation is irreversible
!DHEDGE
!discovery 25
@tipu curate
Upvoted 👌 (Mana: 35/45) Liquid rewards.
Grazie Liberty per il sostegno, in questo post ho riassunto alcune delle nozioni basi della fisica termodinamica. Le seguenti due cose sono tra le più importanti in termodinamica:
1-L'equazione di stato dei gas perfetti
2-La relazione fondamentale per i gas perfetti
This post was shared and voted inside the discord by the curators team of discovery-it
Join our Community and follow our Curation Trail
Discovery-it is also a Witness, vote for us here
Delegate to us for passive income. Check our 80% fee-back Program
grazie per il supporto
Thank you for breaking it down in a simpler step to understand
Hi @precab , In this article I have included some basic concepts that I will summarize briefly.
-The formula representing the second law of thermodynamics for an isolated system is the following:
-In an isolated system the internal energy is constant
In an isolated system the quantities of heat pass from bodies with a higher thermodynamic temperature to bodies with a lower thermodynamic temperature
Thanks for leaving a comment
Sì, l'ho fatto, e il punto è che non lo uso nel mio lavoro, beh, non uso molti concetti che ho imparato.
Solitamente è così. Nella maggior parte dei lavori che eseguiamo usiamo una pare minima di ciò che abbiamo studiato a scuola e a volte anche di quello che studiamo attualmente.